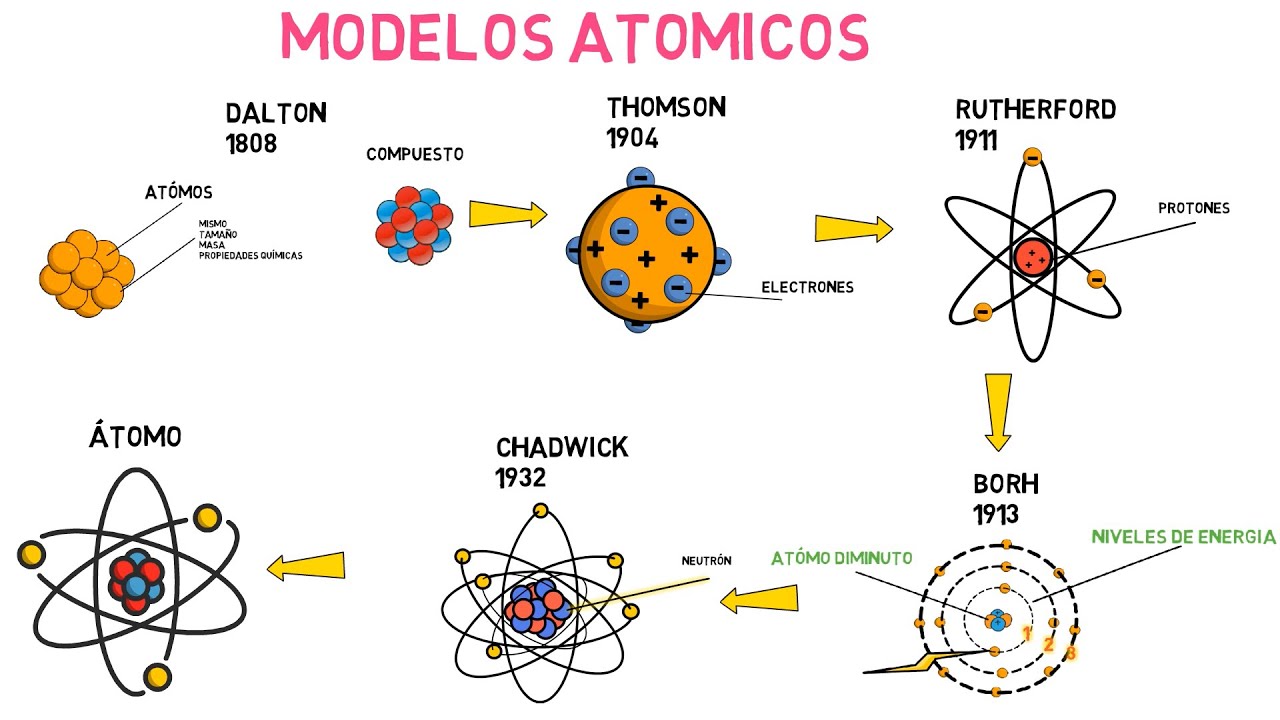
Cuando pensamos en la historia de la ciencia, el desarrollo del modelo atómico es uno de esos hitos que nos lleva a reflexionar sobre cómo hemos llegado a comprender la materia en su forma más básica. En este viaje, uno de los personajes más fascinantes es J.J. Thomson, un físico británico que revolucionó nuestra percepción del átomo a finales del siglo XIX. Su trabajo no solo aportó una nueva dimensión a la física, sino que también sentó las bases para futuras investigaciones. Pero, ¿qué fue lo que realmente hizo Thomson que cambió el rumbo de la ciencia? Vamos a desglosar su contribución de manera sencilla y comprensible.
El Contexto Científico de la Época
Para entender el impacto de Thomson, primero debemos mirar el contexto en el que trabajaba. A finales del siglo XIX, la ciencia estaba en una especie de efervescencia. Se estaban descubriendo nuevos fenómenos eléctricos y magnéticos, y la teoría atómica de Dalton ya había empezado a establecerse como un pilar fundamental de la química. Sin embargo, el modelo atómico de Dalton tenía limitaciones; concebía el átomo como una esfera indivisible. Esto era un buen punto de partida, pero ¿realmente representaba la complejidad de la materia? La respuesta era un rotundo no, y ahí es donde Thomson entró en escena.
El Experimento de la Tubo de Rayos Catódicos
En 1897, Thomson realizó un experimento que cambiaría para siempre la historia de la ciencia. Utilizó un tubo de rayos catódicos, un dispositivo que permitía generar un flujo de electrones. Al aplicar un voltaje a través de un gas a baja presión, observó que se producían rayos que se desviaban al aplicar un campo eléctrico. ¿Qué significaba esto? ¡Que había algo más pequeño que el átomo! Thomson concluyó que estos rayos eran, de hecho, electrones, partículas con carga negativa. Así, propuso que el átomo no era indivisible, sino que estaba compuesto por estas pequeñas partículas cargadas.
El Modelo del Pudín de Ciruelas
Una vez que Thomson descubrió el electrón, propuso su famoso modelo del «pudín de ciruelas». Imagina un pudín, donde las ciruelas son electrones incrustados en una masa positiva, representando la carga positiva del átomo. Este modelo era innovador, ya que sugería que los electrones estaban distribuidos en una esfera de carga positiva, algo que rompía con la visión tradicional de los átomos como entidades indivisibles. Pero, ¿por qué un pudín? Porque, como el pudín, el átomo parecía ser una mezcla homogénea de cargas positivas y negativas. Sin embargo, como veremos más adelante, este modelo no duraría mucho.
Las Implicaciones del Descubrimiento de Thomson
Las aportaciones de Thomson no se limitaron solo a la física. Su descubrimiento de los electrones abrió un mundo completamente nuevo en la química. Imagina que, hasta ese momento, los científicos pensaban que los átomos eran las unidades más pequeñas de la materia. Con el descubrimiento de Thomson, empezamos a ver que hay un mundo de partículas subatómicas que forman la base de todo lo que conocemos. Esto no solo revolucionó la química, sino que también sentó las bases para el desarrollo de la física moderna, incluyendo la mecánica cuántica y la teoría de la relatividad.
Desafíos y Críticas al Modelo de Thomson
A pesar de su genialidad, el modelo de Thomson no era perfecto. Con el tiempo, otros científicos comenzaron a cuestionar su validez. En 1909, Ernest Rutherford realizó su famoso experimento de dispersión de partículas alfa, donde demostró que el átomo tenía un núcleo central denso y cargado positivamente. Esto contradijo la idea de Thomson de que la carga positiva estaba distribuida uniformemente. Así, el modelo del pudín de ciruelas fue reemplazado por el modelo planetario de Rutherford, que presentó un átomo con un núcleo central rodeado de electrones orbitando a su alrededor. Pero, aunque su modelo fue superado, la contribución de Thomson sigue siendo fundamental.
Legado de J.J. Thomson
La historia de Thomson no se detiene en su descubrimiento del electrón. A lo largo de su vida, continuó contribuyendo al campo de la física, recibiendo el Premio Nobel en 1906 por sus investigaciones sobre la conducción eléctrica en gases. Además, su legado se extiende más allá de sus descubrimientos. Su forma de pensar y su metodología científica han influido en generaciones de científicos. Es un recordatorio de que la ciencia es un proceso en constante evolución, donde cada descubrimiento es un ladrillo más en el edificio del conocimiento humano.
El viaje de Thomson a través del mundo de los átomos nos enseña que la curiosidad y la experimentación son fundamentales en la ciencia. A veces, lo que creemos que es cierto puede ser solo la punta del iceberg. Cada descubrimiento abre nuevas preguntas y posibilidades. ¿Qué otras maravillas nos esperan por descubrir? ¿Qué secretos esconde aún el átomo? La historia de Thomson es solo el comienzo de un viaje que aún está en curso.
¿Cuál fue el principal descubrimiento de J.J. Thomson?
Thomson es conocido principalmente por descubrir el electrón, una partícula subatómica que cambió nuestra comprensión de la materia.
¿Qué es el modelo del pudín de ciruelas?
Es un modelo propuesto por Thomson que describe el átomo como una esfera de carga positiva con electrones incrustados en ella, similar a las ciruelas en un pudín.
¿Por qué fue criticado el modelo de Thomson?
Fue criticado porque no podía explicar la estructura del átomo en detalle, lo que llevó a Rutherford a proponer un modelo más preciso con un núcleo central.
¿Qué legado dejó J.J. Thomson en la ciencia?
Thomson dejó un legado duradero al sentar las bases de la física moderna y abrir la puerta a nuevas investigaciones sobre partículas subatómicas.
¿Cómo influyó el descubrimiento de los electrones en la química?
El descubrimiento de los electrones permitió a los científicos entender mejor las interacciones químicas y la estructura atómica, lo que llevó al desarrollo de la teoría cuántica y la química moderna.