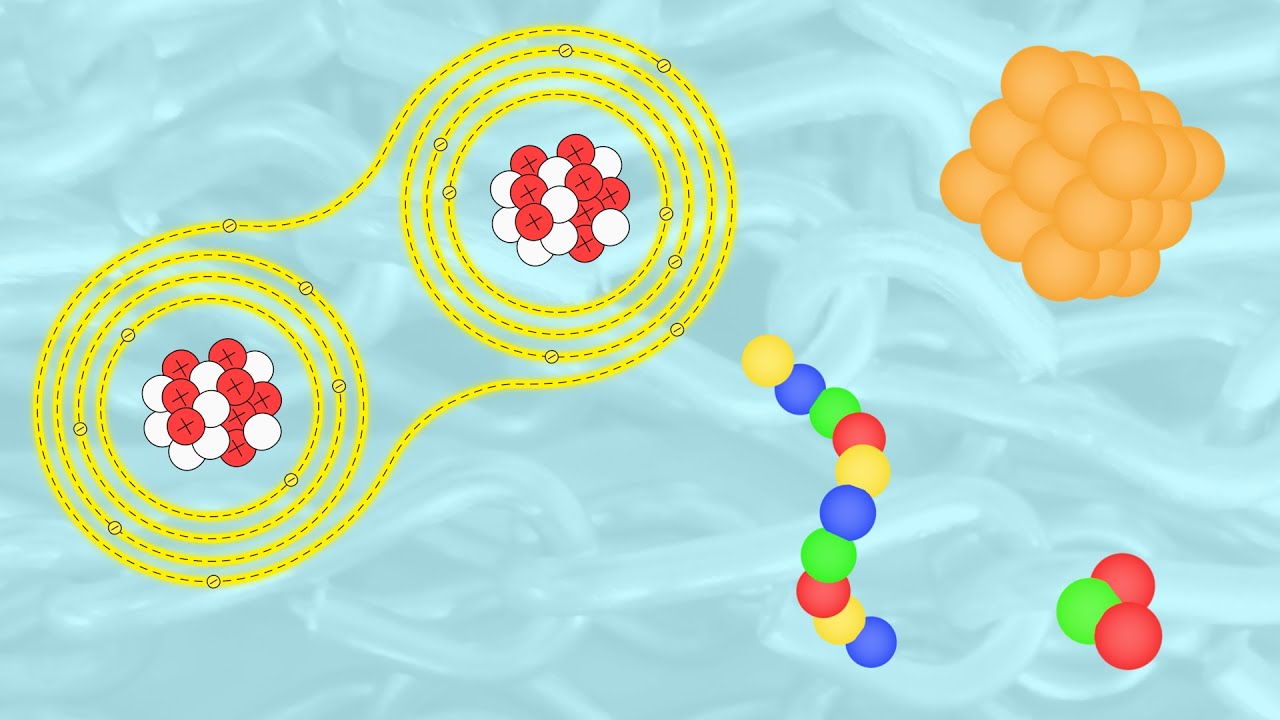
¿Alguna vez te has preguntado cómo se forman las cosas a nuestro alrededor? Desde el aire que respiramos hasta el agua que bebemos, todo está hecho de átomos. Pero, ¿cómo se unen estos pequeños ladrillos de la materia para formar algo más grande y complejo? En este artículo, exploraremos el fascinante mundo de la química, donde los átomos se combinan de maneras sorprendentes. Prepárate para un viaje que te llevará a lo más profundo de la materia y descubrirás cómo se forman los compuestos químicos que dan vida a nuestro universo.
Los átomos son las unidades básicas de la materia. Imagina que son como pequeños bloques de construcción. Cada átomo tiene un núcleo en el centro, compuesto de protones y neutrones, y una nube de electrones que gira a su alrededor. Estos electrones son los que juegan un papel crucial en cómo los átomos se unen entre sí. Hay diferentes maneras en que los átomos pueden unirse, y cada tipo de unión da lugar a diferentes propiedades y comportamientos en las sustancias resultantes. En este artículo, nos enfocaremos en los tipos principales de uniones: enlaces iónicos, covalentes y metálicos.
Enlaces Iónicos: La Fuerza de la Atracción
Comencemos con los enlaces iónicos. Imagina que los átomos son como personas en una fiesta. Algunos de ellos son muy generosos y están dispuestos a compartir, mientras que otros son un poco más egoístas. En el mundo de los átomos, los átomos de metales tienden a ser generosos y donan electrones, mientras que los átomos de no metales son más propensos a recibir esos electrones. Esta transferencia de electrones crea cargas eléctricas opuestas: los átomos que pierden electrones se vuelven positivos (cationes) y los que los ganan se vuelven negativos (aniones).
Cuando un átomo de sodio (Na) se encuentra con un átomo de cloro (Cl), el sodio está más que feliz de donar un electrón al cloro. Esto resulta en un ion sodio positivo y un ion cloruro negativo. La atracción entre estos dos iones de carga opuesta crea un fuerte enlace iónico. ¿Ves cómo dos elementos tan diferentes pueden unirse para formar algo nuevo? Este tipo de unión es lo que forma compuestos como la sal de mesa (NaCl), un elemento esencial en nuestra dieta.
Propiedades de los Compuestos Iónicos
Los compuestos iónicos tienen algunas propiedades fascinantes. Por un lado, suelen tener altos puntos de fusión y ebullición, lo que significa que necesitan mucha energía para descomponerse. Además, en estado sólido, los compuestos iónicos no conducen la electricidad, pero si se disuelven en agua o se funden, se convierten en conductores eléctricos. Esto se debe a que los iones pueden moverse libremente en solución. ¿No es increíble cómo algo tan pequeño puede tener un gran impacto en nuestras vidas?
Enlaces Covalentes: Compartiendo es Cuidar
Ahora, pasemos a los enlaces covalentes. Aquí es donde la historia se vuelve un poco más complicada. En lugar de que un átomo done electrones a otro, los átomos deciden compartir electrones. Piensa en dos amigos que deciden compartir un paraguas en un día lluvioso. Ambos se benefician de la situación, y lo mismo ocurre con los átomos que forman enlaces covalentes.
Un ejemplo clásico de enlace covalente es la molécula de agua (H2O). Cada átomo de hidrógeno (H) comparte un electrón con el átomo de oxígeno (O). Esto significa que el oxígeno tiene acceso a dos electrones compartidos, uno de cada hidrógeno. Este tipo de unión crea una molécula estable y permite que el agua tenga propiedades únicas, como su capacidad para disolver muchas sustancias.
Características de los Compuestos Covalentes
Los compuestos covalentes suelen tener puntos de fusión y ebullición más bajos que los compuestos iónicos. Esto se debe a que las fuerzas que mantienen juntas las moléculas covalentes son generalmente más débiles que las fuerzas que mantienen unidos a los iones en los compuestos iónicos. Además, muchos compuestos covalentes no conducen electricidad, ya que no tienen iones libres que puedan moverse. Sin embargo, son esenciales para la vida, ya que forman la base de la biología y la química orgánica.
Enlaces Metálicos: El Club de los Electrones
Finalmente, llegamos a los enlaces metálicos. Si pensabas que los enlaces covalentes eran complicados, prepárate, porque los enlaces metálicos son como una fiesta de electrones. En los metales, los átomos no solo comparten electrones entre sí, sino que estos electrones son muy móviles y forman un «mar de electrones». Esto significa que los electrones pueden moverse libremente entre los átomos metálicos, lo que da lugar a algunas propiedades muy interesantes.
Imagina una gran reunión donde todos están bailando. Cada persona (átomo de metal) tiene su propio espacio, pero los bailarines (electrones) pueden moverse entre ellos sin problemas. Esto es lo que permite que los metales sean buenos conductores de electricidad y calor. Además, los metales son maleables y dúctiles, lo que significa que pueden ser moldeados en diferentes formas sin romperse.
Ejemplos de Materiales Metálicos
Los metales como el cobre, el oro y el hierro son ejemplos de materiales que exhiben enlaces metálicos. El cobre es ampliamente utilizado en cables eléctricos debido a su excelente conductividad, mientras que el oro se utiliza en joyería y en la industria electrónica. ¿No es asombroso cómo la estructura de los átomos en un metal puede influir en su uso en el mundo real?
La Importancia de los Enlaces Químicos en la Vida Diaria
Ahora que hemos explorado los diferentes tipos de enlaces químicos, es importante destacar cómo estos afectan nuestras vidas diarias. Desde los alimentos que comemos hasta los productos que usamos, los enlaces químicos son fundamentales en la creación de sustancias que son esenciales para nuestra existencia.
Por ejemplo, los alimentos están compuestos de moléculas orgánicas que se forman a través de enlaces covalentes. Las proteínas, carbohidratos y grasas son todos ejemplos de compuestos que se forman a partir de la unión de átomos mediante enlaces covalentes. Además, los medicamentos que tomamos y los productos de limpieza que utilizamos están hechos de compuestos químicos que dependen de la forma en que los átomos se unen entre sí.
Impacto Ambiental y Química
La química también juega un papel crucial en cuestiones ambientales. Los contaminantes en el aire y el agua a menudo son compuestos químicos que se forman a través de reacciones entre diferentes sustancias. Comprender cómo se unen los átomos y cómo se forman estos compuestos puede ayudarnos a desarrollar soluciones para problemas ambientales y mejorar nuestra calidad de vida.
En resumen, los átomos son como piezas de un rompecabezas, y los enlaces químicos son las conexiones que los unen. Ya sea a través de enlaces iónicos, covalentes o metálicos, la forma en que se unen los átomos determina las propiedades y comportamientos de las sustancias que nos rodean. Desde la sal que espolvoreamos en nuestra comida hasta el agua que bebemos, cada elemento tiene su propia historia que contar.
Así que la próxima vez que mires a tu alrededor, recuerda que todo está hecho de átomos que se han unido de maneras asombrosas. La química es más que solo fórmulas y ecuaciones; es la historia de cómo se forma el mundo que conocemos.
¿Qué es un enlace iónico?
Un enlace iónico es una conexión entre átomos donde uno de ellos dona electrones y el otro los recibe, formando iones de carga opuesta que se atraen entre sí.
¿Cómo se forman los enlaces covalentes?
Los enlaces covalentes se forman cuando dos átomos comparten electrones para alcanzar una configuración electrónica más estable.
¿Por qué los metales son buenos conductores de electricidad?
Los metales son buenos conductores de electricidad debido a la presencia de un «mar de electrones» que permite que los electrones se muevan libremente entre los átomos.
¿Qué papel juega la química en el medio ambiente?
La química es fundamental en el medio ambiente, ya que ayuda a entender cómo se forman los contaminantes y cómo podemos desarrollar soluciones para problemas ambientales.
¿Qué ejemplos de compuestos covalentes hay en la vida diaria?
Ejemplos de compuestos covalentes incluyen el agua (H2O), el dióxido de carbono (CO2) y los azúcares, que son esenciales en nuestra dieta y en la biología en general.